Электричество и магнетизм. Часть 2
- Электричество и магнетизм. Часть 2
- 2.2. Закон Ома для однородного участка цепи. Сопротивление проводников.
- 2.3. Дифференциальная форма закона Ома.
- 2.4. Сторонние силы. ЭДС источника тока. Закон Ома для неоднородного участка цепи и для замкнутой цепи.
- 2.5. Напряжение на зажимах источника тока.
- 2.6. Разветвленные цепи. Правила Кирхгофа.
- . 2.7. Соединение сопротивлений.
- 2.8. Работа и мощность постоянного тока. Закон Джоуля — Ленца.
- 2.9. КПД источника тока.
- 2.10. Природа носителей тока в металлах.
- 2.11. Основные положения классической электронной теории проводимости металлов Друде — Лоренца.
- 2.12. Вывод законов Ома, Джоуля-Ленца и Видемана-Франца на основе теории Друде-Лоренца.
- 2.13. Затруднения классической теории электропроводности металлов. Сверхпроводимость металлов.
- 2.14. Электрический ток в электролитах. Законы электролиза Фарадея.
- 2.15. Электропроводность газов. Основные виды газового разряда. Плазма.
- 2.16. Электрический ток в вакууме. Работа выхода электрона из металла.
- 3.1. Взаимодействие проводников с током. Закон Ампера.
- 3.2. Закон Био-Савара-Лапласа. Принцип суперпозиции магнитных полей.
- 3.3. Примеры вычисления магнитных полей с помощью закона Био-Савара-Лапласа.
- 3.4. Магнитный момент тока.
- 3.5. Магнитное поле на оси кругового витка с током.
- 3.6. Момент сил, действующих на контур с током в магнитном поле.
- 3.7. Энергия контура с током в магнитном поле.
- 3.8. Контур с током в неоднородном магнитном поле.
- 3.9. Работа, совершаемая при перемещении контура с током в магнитном поле.
- 3.10. Поток вектора магнитной индукции. Теорема Гаусса в магнитостатике
- 3.11. Теорема о циркуляции магнитного поля. Магнитное напряжение.
- 3.12. Магнитное поле соленоида и тороида.
Лекция 7
Электрический ток в различных средах.
2.14. Электрический ток в электролитах. Законы электролиза Фарадея.
Электролиты относятся к так называемым проводникам второго рода. В отличие от металлов и полупроводников (проводников первого рода), протекание тока в которых не сопровождается какими-либо химическими превращениями, в электролитах протекание тока всегда сопровождается химическими превращениями. Электролитами являются растворы солей, кислот и щелочей в воде и некоторых других жидкостях, а также расплавы солей, являющихся в твердом состоянии ионными кристаллами.
Носителями тока в электролитах являются положительные и отрицательные ионы, на которые диссоциируют (расщепляются) молекулы растворенного вещества. Степень диссоциации характеризуется коэффициентом диссоциации α, показывающим, какая доля молекул растворенного вещества находится в диссоциированном состоянии. Коэффициент диссоциации зависит от химической природы растворителя и концентрации растворяемого вещества. В частности, чем ниже концентрация растворяемого вещества, тем выше коэффициент диссоциации.
Если в электролит ввести твердые проводящие электроды и подать на них напряжение, то ионы придут в движение — возникнет электрический ток (рис.7.1). Положительные ионы (катионы) движутся к отрицательному электроду (катоду); отрицательные ионы (анионы) — к положительному электроду (аноду).
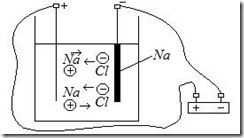
Рис.7.1. Электрический ток в электролите.
Достигнув соответствующих электродов, анионы и катионы отдают избыточные или получают недостающие электроны и превращаются в нейтральные молекулы. Таким образом, прохождение электрического тока через электролит сопровождается выделением на электродах составных частей электролита. Это явление называется электролизом. Основные законы электролиза были установлены в 1836г. Майклом Фарадеем (Faraday M., 1791-1867):
Первый закон Фарадея. Количество вещества, выделившегося на каждом из электродов при электролизе, пропорционально заряду, протекшему через электролит:
![]() ,
,
где К- электрохимический эквивалент, зависящий от природы вещества.
Второй закон Фарадея. Электрохимический эквивалент всех веществ пропорционален их химическому эквиваленту:
![]()
![]()
где ![]() — атомный вес,
— атомный вес, ![]() — валентность химического элемента;
— валентность химического элемента; ![]() -число Фарадея.
-число Фарадея.
Выделение вещества на электродах начинается лишь с некоторого напряжения, называемого пороговым напряжением разложения электролита Up. Начиная с этого напряжения, в электролите появляется ток, плотность которого подчиняется закону Ома:
![]()
где n+ и n- — концентрация положительных и отрицательных ионов, соответственно; q+ и q- — заряды ионов; u+и u- — подвижности ионов; σ — электропроводность электролита.
Подвижность ионов зависит от их природы и свойств растворителя. С повышением температуры подвижность ионов возрастает. В электролитах подвижность ионов очень мала. Так, для водных растворов при комнатной температуре она составляет 10-8-10-7 ![]() (для сравнения, подвижность электронов в металлах ~10-4
(для сравнения, подвижность электронов в металлах ~10-4![]() ).
).
Если молекула диссоциирует только на пару ионов, то ![]() и
и ![]() . В этом случае
. В этом случае
![]()
На рис.7.2 представлена ВАХ электролита: ![]() , R — сопротивление слоя электролита между электродами.
, R — сопротивление слоя электролита между электродами.
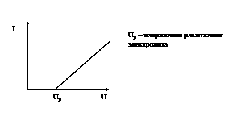
Рис.7.2. Вольтамперная характеристика электролита.
Электролиз находит самые разнообразные технические применения: гальванопластика и гальваностегия; электрометаллургия; электрополировка металлов; получение тяжелой воды и другие.
