Физика полупроводников. Лекция 1
- Физика полупроводников. Лекция 1
- Глава I. Структура полупроводниковых кристаллов
- §1.2. Элементы симметрии кристаллов.
- §2.1. Оси симметрии.
- §2.2. Плоскости симметрии.
- §2.3. Зеркально — поворотные оси симметрии.
- §3. Типы простых кристаллических решеток.
- §4. Кристаллографические индексы Миллера.
- §5. Обратная решетка кристалла и ее ячейка Вигнерра — Зейтца. .
- §6. Связь между структурами прямой и обратной решеткой кристалла.
- §7. Построение зон Бриллюэна для каждой из некоторых типов кристаллических решеток.
- 7.2 Кубическая гранецентрированная решетка.
- 7.3. Гексагональная решетка.
- 7.4. Кристаллы графита.
- §8. Структура основных типов полупроводниковых кристаллов.
- §9. Неупорядоченные (некристаллические полупроводники).
- §10. Типы и структура жидких кристаллов.
- §11.Жидко кристаллические приборы для отображения информации.
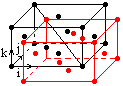 1. Наиболее широкое применение в твердотельной электронике нашли кристаллы германия и кремния. Они кристаллизуются в одинаковую решетку типа алмаза. Ее можно представить в виде системы двух кубических гранецентрированных подрешеток, сдвинутых одна относительно другой на ¼ часть ее длины и занятых атомами одинакового типа. Базисной ячейкой является ромбоэдрической, построенная на векторах:
1. Наиболее широкое применение в твердотельной электронике нашли кристаллы германия и кремния. Они кристаллизуются в одинаковую решетку типа алмаза. Ее можно представить в виде системы двух кубических гранецентрированных подрешеток, сдвинутых одна относительно другой на ¼ часть ее длины и занятых атомами одинакового типа. Базисной ячейкой является ромбоэдрической, построенная на векторах: ![]() ,
, ![]() ,
, ![]() , ее объем равен
, ее объем равен ![]() . Повторением в пространстве гранецентрированного куба “черными” атомами получаем первую подрешетку кристалла. Повторением в пространстве гранецентрированного куба “красными” атомами получаем вторую подрешетку кристалла. Внутри куба с “черными” атомами, как видно находятся четыре “красных” атома они занимают центры четырех октантов. Так как объем базисной ячейкой равен ¼ части куба, то на базисную ячейку приходится S = 2 атома: один атом от вершин ячейки и один атом лежащий внутри куба. Зона Бриллюэна кристаллов германия и кремния усеченный октаэдр.
. Повторением в пространстве гранецентрированного куба “черными” атомами получаем первую подрешетку кристалла. Повторением в пространстве гранецентрированного куба “красными” атомами получаем вторую подрешетку кристалла. Внутри куба с “черными” атомами, как видно находятся четыре “красных” атома они занимают центры четырех октантов. Так как объем базисной ячейкой равен ¼ части куба, то на базисную ячейку приходится S = 2 атома: один атом от вершин ячейки и один атом лежащий внутри куба. Зона Бриллюэна кристаллов германия и кремния усеченный октаэдр.
2. Большая группа полупроводниковых соединений AIIBVI (ZnS, ZnSe, ZnTe, CdTe) и AIIIBV (GaAs, GaP, InSb) кристаллизуются в решетку цинковой обманки (минерал ZnS) типа сфалерита. Решетку таких кристаллов можно представить в виде системы дух кубических гранецентрированных подрешеток, сдвинутых одна относительно другой вдоль главной диагонали на ¼ ее длины и занятых атомами разного типа (смотри решетку типа алмаза). Тип решетки таких кристаллов — кубическая гранецентрированная, базисная ячейка ромбоэдрическая, на нее приходится S = 2 атома, что соответствует химической формуле. Наиболее плотно упакованной плоскостью является {111}. В каждой такой плоскости каждый атом окружен ближайшими шестью такими же атомами. Атомы, расположенные в плоскостях сверху и снизу от исходной плоскости заполняют лунки исходного слоя и это атомы второго типа. Таким образом, каждый атом в кристаллах типа сфалерита окружен 12-ю атомами: с 6-ю атомами одного типа и с 6-ю атомами другого типа, т. е. координатное число равно 12. Зона Бриллюэна усеченный октаэдр.
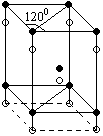 3. небольшая группа полупроводниковых кристаллов (ZnS, CdS, CdSe) кристаллизуется в гексагональную решетку цинковой обманки типа вюрцита. Решетку таких кристаллов можно получить в пространстве базисной ячейки, которая представляет собой прямую призму в основании которой находится ромб с углом 1200, ее можно представить в виде системы двух трехгранных призм. Атомы одного типа находятся в вершинах и в центре одной трехгранной призмы. Атомы второго типа располагаются на ребрах и внутри трехгранной призмы, в которой находится черный атом. На одну примитивную ячейку приходится S = 4 атома, 2 белых и 2 черных атома.
3. небольшая группа полупроводниковых кристаллов (ZnS, CdS, CdSe) кристаллизуется в гексагональную решетку цинковой обманки типа вюрцита. Решетку таких кристаллов можно получить в пространстве базисной ячейки, которая представляет собой прямую призму в основании которой находится ромб с углом 1200, ее можно представить в виде системы двух трехгранных призм. Атомы одного типа находятся в вершинах и в центре одной трехгранной призмы. Атомы второго типа располагаются на ребрах и внутри трехгранной призмы, в которой находится черный атом. На одну примитивную ячейку приходится S = 4 атома, 2 белых и 2 черных атома.
В кристаллах типа вюрцита базисная плоскость является {1000}, в ней каждый атом данного типа окружен 6-ю атомами. Атомы другого типа располагаются в верхней и нижней плоскостях {1000}, в лунках исходного слоя. Таким образом, каждый атом окружен 12-ю ближайшими атомами. Зона Бриллюэна — шестигранная призма.
4. Ряд ионных кристаллов, имеющих химическую формулу AB2 и A2B, кристаллизуются в кубическую решетку типа флюорита (минерал CaF2), так например в такую решетку кристаллизуются кристаллы Cu2O, Cu2S, Cu2Te.
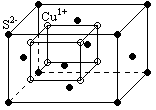 Элементарная ячейка таких кристаллов представляет собой гранецентрированный куб (большой куб), заполненный атомами A, если химическая формула (AB2), или атомами B, если химическая формула (A2B). Атомы B или A, находятся внутри большого гранецентрированного куба в центрах его 8-ми октантов, образуя, таким образом малый куб. Базисной ячейкой является ромбоэдрическая, ее объем равен
Элементарная ячейка таких кристаллов представляет собой гранецентрированный куб (большой куб), заполненный атомами A, если химическая формула (AB2), или атомами B, если химическая формула (A2B). Атомы B или A, находятся внутри большого гранецентрированного куба в центрах его 8-ми октантов, образуя, таким образом малый куб. Базисной ячейкой является ромбоэдрическая, ее объем равен ![]() . На одну примитивную ячейку приходится S = 3 атома.
. На одну примитивную ячейку приходится S = 3 атома.
