Курс лекций по “Общей экологии”. Часть 1
- Курс лекций по “Общей экологии”. Часть 1
- Учение Вернадского о биосфере
- три биогеохимических принципа
- Разделы экологии
- Иерархия биосистем
- Принцип эмерджентности
- Популяции
- Адаптация, изменение или вымирание видов
- Сообщество, абиотическая среда и биогеоценоз
- Энергия в экосистемах
- Законы термодинамики
- Теории классической термодинамики
- Трофические цепи и уровни
- Экологический смысл фотосинтеза
- Структура и основные компоненты экосистем
- Свойства экологических систем
- Закономерности функционирования экосистем
- Гомеостаз экосистемы
- Равновесие в экосистемах
Законы термодинамики
Первый закон термодинамики — закон сохранения энергии. Он гласит: Энергия не создается и не исчезает. Для любого химического процесса общая энергия в замкнутой системе всегда остается постоянной. Экология изучает связь между солнечным светом и экологическими системами, внутри которых происходят превращения энергии света. Энергия не создается заново и никуда не исчезает. Свет как одна из форм энергии может быть превращен в работу, теплоту или потенциальную энергию химических веществ пищи. Из этого следует, что если какая-либо система (как неживая, так и живая) получает или затрачивает энергию, то такое же количество энергии должно быть изъято из окружающей ее среды. Энергия может лишь перераспределяться либо переходить в другую форму в зависимости от ситуации, но при этом она не может возникнуть ниоткуда или бесследно исчезнуть.
Лучистая энергия Солнца, попав на Землю, стремится превратиться в рассеянную тепловую. Доля световой энергии, преобразованная зелеными растениями в потенциальную энергию их биомассы, намного меньше поступившей (qконц < Qсол). Незначительная часть энергии отражается, основная же ее часть превращается в теплоту, покидающую затем и растения, и экосистему и биосферу.
Второй закон термодинамики гласит: процессы, связанные с превращением энергии, могут происходить самопроизвольно только при условии, что энергия переходит из концентрированной формы в рассеянную (деградирует). Этот закон называют законом энтропии. Теплота не передается самопроизвольно от более холодного тела к более горячему (хотя первый закон такой переход не запрещает). В природе масса примеров однонаправленных процессов. Например, газы перемешиваются в сосуде, но сами не разделяются, кусок сахара растворяется в воде, но не выделяется обратно в виде куска. Мерой количества связанной энергии, которая становится недоступной для использования, является энтропия (от греч. внутрь и превращение). Т.е. энтропия является мерой беспорядка, мерой количества связанной энергии, которая становится недоступной для использования. В замкнутых системах энтропия (S) не может убывать; ее изменение (ΔS) равно нулю при обратимых процессах или больше нуля — при необратимых процессах. Система и ее окружение, предоставленные сами себе, стремятся к состоянию максимальной энтропии (неупорядоченности). Таким образом, самопроизвольные процессы идут в сторону увеличения беспорядка.
Второй закон термодинамики можно сформулировать также следующим образом: поскольку некоторая часть энергии всегда рассеивается в виде не доступных для использования тепловых потерь энергии, эффективность превращения энергии света в потенциальную энергию химических соединений всегда меньше 100%. Существует еще одна формулировка закона: любой вид энергии в конечном счете переходит форму, наименее пригодную для использования и наиболее легко рассеивающуюся.
Отношения между растениями — продуцентами и животными — консументами управляются потоком аккумулированной растениями энергии, которая используется затем животными. Весь живой мир получает необходимую энергию из органических веществ, созданных растениями и, в меньшей мере, хемосинтезирующими организмами. Пища, созданная в результате фотосинтетической деятельности зеленых растений, содержит потенциальную энергию химических связей, которая при потреблении ее животными организмами превращается в другие формы. Животные, поглощая энергию пищи, также большую ее часть переводят в теплоту, а меньшую — в химическую потенциальную энергию синтезируемой ими протоплазмы.
Согласно первому закону термодинамики энергия, поступающая в систему из четырех источников: от солнца, от дождя, в виде питательных веществ почвы и человека, машин, топлива. Она преобразуется в два потока: выносимую из системы энергию продуктов питания и рассеянную тепловую энергию. Энергия, участвующая в процессе производства продуктов питания, превращается в основном в рассеянную тепловую. Лишь небольшая часть ее сохраняется в продуктах. Согласно второму закону количество энергии, заключенной в продуктах, меньше общего количества поступившей энергии. Рассеиваемая теплота — это энергия хаотического движения молекул, которое мы воспринимаем как ощущение тепла, для всех энергетических процессов, в том числе и технологических, характерен переход от более высокого уровня организации («порядка») к более низкому («беспорядку»). Эту тенденцию потенциальной энергии к деградации выражают термином возрастания энтропии (ΔS). Одновременно энергетические потоки создают (возможно, спонтанно) из хаоса природных веществ порядок. Структуры, наделенные порядком, обладают низкой энтропией. Все типы неживых систем регулируются теми же законами термодинамики, которые управляют и живыми системами. Различие заключается в том, что живые системы, используя часть имеющейся внутри них потенциальной энергии, способны самовосстанавливаться, а неживые системы приходится восстанавливать, используя внешнюю энергию, превращая ее в формы, практически недоступные для использования.
Согласно третьему закону термодинамики, при стремлении абсолютной температуры простых кристаллических тел к нулю абсолютное значение их энтропии также стремится к нулю.
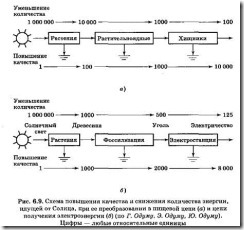
Энергия характеризуется не только ее количеством, но и качеством. Чем более концентрирован энергетический поток, тем выше его качество — способность превращаться в другую форму энергии (или соотношение части энергии, способной сконцентрироваться и рассеиваемой части энергии). В пищевой цепи и цепи получения электроэнергии (рис. 6.9), включающей этап фоссилизации количество энергии всегда уменьшается, а ее качество увеличивается. Фоссилизация (от лат. ископаемый) — процесс превращения останков вымерших животных и растений в окаменелости путем замещения органических веществ минеральными.
Важнейшая особенность живых организмов, экосистем и биосферных в целом — это способность создавать и поддерживать высокую степень внутренней упорядоченности, т. е. состояние с низкой энтропией. Следовательно, экосистемы и организмы представляют собой открытые неравновесные термодинамические системы, которые постоянно обмениваются с окружающей средой энергией и веществом, уменьшая этим энтропию внутри себя, но увеличивая ее вовне в соответствии с законами термодинамики. Все разнообразие проявлений жизни сопровождается пре вращениями энергии без ее возникновения или исчезновения. Суть жизни состоит в непрерывной последовательности таких изменений, как рост, самовоспроизведение и синтез сложных химических соединений.
Экология изучает способы превращения энергии внутри экосистем. Внутри Солнца происходят термоядерные реакции. Энергия этих реакций переходит в энергию света, т. е. энергию квантов излучения, испускаемого Солнцем.
Для биосферы допустимо потребление на какие-либо иные нужды, кроме собственных, не более 1% от ее общей первичной продукции. Как только человечество на грани ХIХ и ХХ вв. стало использовать большее количество так, вероятно, с величины 0,5% от общей энергетики биосферы прекратилось действие компенсационного механизма на основе принципа Ле Шателье—Брауна: растительность прекратила давать прирост биомассы, пропорциональный увеличению концентрации СО2 в атмосфере.
Признан ориентировочный порог потребления 5—10% от суммы веществ, приводящий при переходе через него к заметным изменениям в природных системах . Считается, что для природных систем при внесении в них возмущения на уровне 1% (правило 1%) от общего потока энергии, проходящего через систему, находится порог выхода си темы из стационарного состояния, а на уровне 10% — порог саморазрушения системы. Особое значение имеет момент выхода из стационарного состояния . Для глобальной энергетической системы (биосферы) этот процесс, по мнению Н. Ф. Реймерса, начинается от привнесения возмущений на уровне 0,1—0,2% от величины общепланетарных процессов, т. е. намного раньше, чем наступает момент сбоя в действии принципа Ле Шателье –Брауна. Происходят заметные природные аномалии. Так, существенный рост опустынивания отмечен еще в прошлом веке, а влияние деятельности человека на глобальные климатические процессы за последние двести лет окончательно доказано лишь к концу второго тысячелетия.
